醫(yī)療器械
醫(yī)療器械
根據(jù)國(guó)家認(rèn)監(jiān)委發(fā)布的《醫(yī)療器械監(jiān)督管理?xiàng)l例》第一章第四條國(guó)家對(duì)醫(yī)療器械按照風(fēng)險(xiǎn)程度實(shí)行分類管理。第一類是風(fēng)險(xiǎn)程度低,實(shí)行常規(guī)管理可以保證其安全、有效的醫(yī)療器械。第二類是具有中度風(fēng)險(xiǎn),需要嚴(yán)格控制管理以保證其安全、有效的醫(yī)療器械。第三類是具有較高風(fēng)險(xiǎn),需要采取特別措施嚴(yán)格控制管理以保證其安全、有效的醫(yī)療器械。同時(shí)該條例規(guī)定第一類醫(yī)療器械產(chǎn)品備案和申請(qǐng)第二類、第三類醫(yī)療器械產(chǎn)品注冊(cè)。
提交下列資料:
(一)產(chǎn)品風(fēng)險(xiǎn)分析資料;
(二)產(chǎn)品技術(shù)要求;
(三)產(chǎn)品檢驗(yàn)報(bào)告;
(四)臨床評(píng)價(jià)資料;
(五)產(chǎn)品說(shuō)明書(shū)及標(biāo)簽樣稿;
(六)與產(chǎn)品研制、生產(chǎn)有關(guān)的質(zhì)量管理體系文件;
(七)證明產(chǎn)品安全、有效所需的其他資料。
醫(yī)療器械注冊(cè)申請(qǐng)人、備案人應(yīng)當(dāng)對(duì)所提交資料的真實(shí)性負(fù)責(zé)。
我們的能力
中檢科?。ㄌ旖颍z驗(yàn)檢測(cè)有限責(zé)任公司遵循《醫(yī)療器械監(jiān)督管理?xiàng)l例》及《醫(yī)療器械檢驗(yàn)工作規(guī)范》根據(jù)醫(yī)療器械分類開(kāi)展毒理學(xué)試驗(yàn),并出具具有CNAS資質(zhì)的檢測(cè)報(bào)告(含結(jié)論)




我們的服務(wù)—毒理學(xué)試驗(yàn)
依據(jù)GB/T16886國(guó)家標(biāo)準(zhǔn)開(kāi)展下列檢驗(yàn)項(xiàng)目
項(xiàng)目
|
方法依據(jù)
|
哺乳動(dòng)物紅細(xì)胞微核試驗(yàn)
|
醫(yī)療器械生物學(xué)評(píng)價(jià)
|
細(xì)菌回復(fù)突變?cè)囼?yàn)
|
|
體外哺乳類細(xì)胞染色體畸變?cè)囼?yàn)
|
|
體外細(xì)胞毒性試驗(yàn)
|
|
眼刺激試驗(yàn)
|
|
陰道刺激試驗(yàn)
|
|
皮膚單次接觸毒性試驗(yàn)
|
|
皮膚重復(fù)接觸毒性試驗(yàn)
|
|
皮膚致敏毒性試驗(yàn)
|
|
急性經(jīng)口全身毒性試驗(yàn)
|
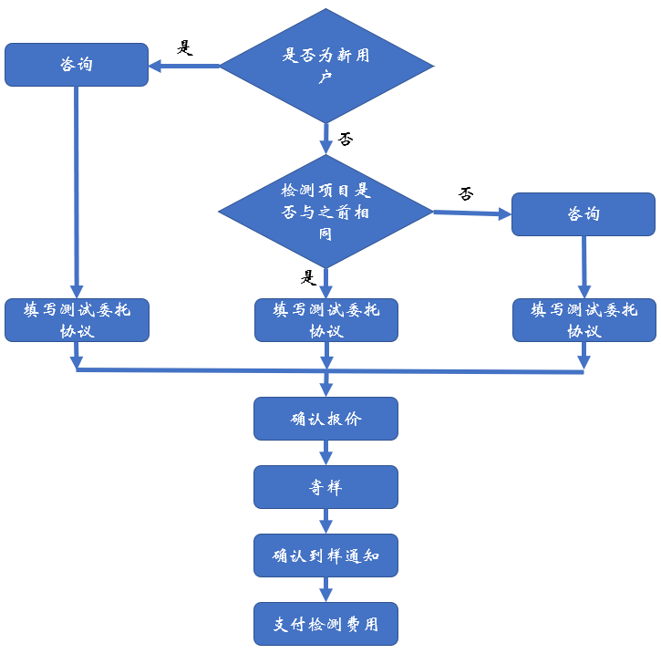
服務(wù)流程: